 首页
>
成功案例
>
【510K】仅用30天为客户获得K号!
首页
>
成功案例
>
【510K】仅用30天为客户获得K号!

【510K】仅用30天为客户获得K号!
背景
1个月前,某客户求助沙格公司希望自己的静脉注射器产品能尽快获得K号。该客户的诉求有3点:同时客户反映了一个情况,就是客户在21年获得过一个静脉注射器的K号。这次申请的4个型号产品和以前获批的产品比,主要是某个部件的结构设计和材料发生了变化,但是预期用途和功能没有变化。沙格的咨询老师将客户21年获批产品和本次申请的产品仔细比对研究后,决定为客户用special的方式进行申报,从而可以将审批时间缩短到30天,满足客户的诉求,并最终用30天为客户顺利获得K号。什么是特殊提交
(special submission)?
特殊510(k)是FDA审查和批准制造商的自有合法上市同品种器械的变更。对于特殊提交的适用范围申请人必须准确判断,一旦FDA认为该申请不适用特殊提交,那么申请提交后FDA会将该申请转为传统提交。判断是否可以进行特殊提交,请看图1: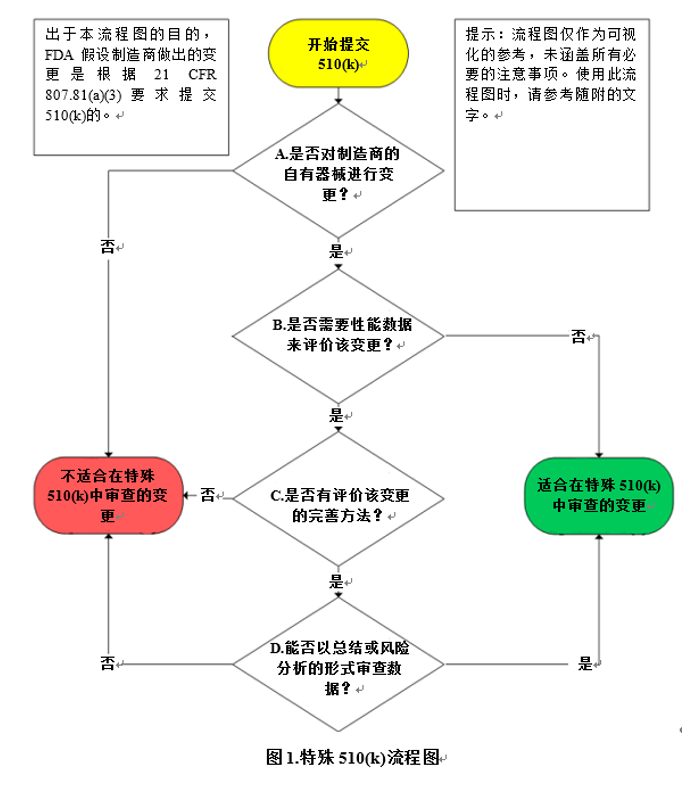
特殊提交和传统提交的一个很大不同就是,特殊提交时FDA不审查完整试验报告。因此申请人必须提供:传统提交时,附上性能数据报告就可以,因此咨询老师只要审核报告的完整性和适宜性即可。而特殊提交,FDA只审查你的总结。因此对于咨询老师从企业已实施的验证和/或性能测试的报告中总结出充分,适宜,有效的内容就提出了很大的挑战。在该客户的资料准备过程中,沙格的咨询老师和企业的测试工程师多次开会讨论每一个检测项目的详细内容,最后终于编制出了完善的总结报告。特殊提交的优势
特殊提交时,FDA预期30天内进行评审。因此和传统提交相比,大大缩短了评审周期。
器械的变更评价3个以上的科学学科(例如生物相容性、无菌性、电磁兼容性),那这类器械不再适用特殊提交。当针对FDA通常必须审查完整试验报告以建立实质等同的情况:- 从一次性使用改为可重复使用时应提供再加工确认或人为因素数据;
- 使用国际标准化组织(ISO)10993-1820的分析化学试验和/或使用ISO 10993-1721的毒理学风险评价来解决生物相容性问题。
















